Zusammenfassung: Die neuen Leitlinien der European Society of Cardiology (ESC) und der European Atherosclerosis Society (EAS) erweitern erheblich den Kreis der medikamentös behandlungsbedürftigen Menschen mit Hyperlipidämien. Die Grenze zwischen Primär- und Sekundärprävention wird aufgehoben, und die LDL-Zielwerte werden nochmals stark herabgesetzt. Ezetimib und PCSK9-Hemmer erhalten eine Klasse-1-Empfehlung, ohne dass es neue und stichhaltige Belege für eine günstige Nutzen-Risiko-Relation oder Kosteneffektivität gibt. Die Zielvorgabe „as low as possible“ scheint aber nicht nur für das LDL-Cholesterin, sondern auch für das Evidenzniveau der Leitlinie zu gelten, denn diese ist in vielen formalen Punkten kritikwürdig, sodass sie nach unserer Einschätzung allenfalls als interessengeleitetes Positionspapier einer industrienahen Fachgesellschaft bezeichnet werden kann.
Die ESC und EAS haben im August 2019 ihre 3 Jahre alten Leitlinien zum Management von Dyslipidämien „aktualisiert“ (1). Diese beinhalten sehr weitreichende Empfehlungen, die die Diskussionen in den nächsten Jahren bestimmen werden. Daher sollen einige wichtige Punkte hier zusammengefasst und kommentiert werden. Die Definitionen der angegebenen Empfehlungsgrade sowie Stufen der angegebenen Beweiskraft sind in Tab. 1 aufgeführt.
Grundrisiko: Ausgangspunkt aller Überlegungen ist das kardiovaskuläre Grundrisiko (CV-GR). Dieses soll, einschließlich des Lipidprofils, bei allen asymptomatischen Erwachsenen > 40 Jahren (1/C) erstellt werden. Die Risikoberechnung erfolgt mit den sog. SCORE-Cards der ESC (SCORE = Systematic COronary Risk Evaluation; vgl. 10). Diese basieren auf den Daten von Europäern. Es gehen fünf Variable in diesen Rechner ein: Alter, Geschlecht, systolischer Blutdruck, Gesamtcholesterin und Raucherstatus. Modifizierte Versionen mit HDL-C oder Triglyzeriden (TG) stehen in einer Web-Version zur Verfügung oder sollen erarbeitet werden. Die Anwendung dieses Scores ist nur für Personen bis 65 Jahren möglich; bei älteren überschätzt der Rechner das CV-GR. Für Menschen mit Diabetes mellitus (DM) oder Familiärer Hyperlipidämie (FH) wird der Rechner nicht empfohlen (3/C).
Berechnet wird die 10-Jahres-Wahrscheinlichkeit für einen CV-Tod. Dieser Zielparameter wurde gewählt, weil er nicht störanfällig für unterschiedliche Krankheitsdefinitionen ist, z.B. was ein akutes Koronarsyndrom (ACS) ist. Nicht tödliche CV-Ereignisse kommen etwa dreimal häufiger vor.
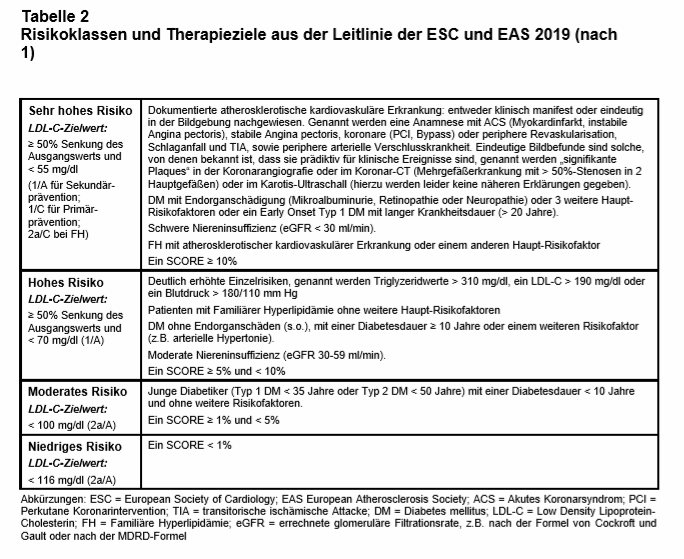
Es gibt nach wie vor 4 CV-Risiko-Stufen, obwohl es sich beim CV-Risiko um ein Kontinuum handelt. Die gezogenen Grenzen seien notwendig, weil Ärzte sich gerne an solchen Grenzwerten orientieren. Es wird ein sehr hohes (> 10%), hohes (5-9%), moderates (3-4%) und geringes 10-Jahres-CV-GR (< 3%) unterschieden (s. Tab. 2). Da es starke regionale Unterschiede bei der CV-Letalität gibt, wird die Berechnung für die jeweiligen ESC-Mitgliedsländer „kalibriert“ – von Island bis Tadschikistan. Deutschland und Österreich zählen zur Region mit niedrigem Risiko.
Bei bestimmten Personengruppen ist eine solche Risikoberechnung nicht erforderlich – sie haben grundsätzlich ein hohes bzw. sehr hohes CV-GR. Hierzu zählen Patienten mit klinisch manifester CV-Erkrankung (Herzinfarkt, instabile Angina pectoris, Schlaganfall oder nach arteriellen Gefäßinterventionen), also die klassische Sekundärprophylaxe. Darüber hinaus zählen nun aber auch alle asymptomatischen Personen mit zufällig dokumentierter Atherosklerose im Gefäß-Ultraschall oder im Koronar-CT oder mit langjährigem DM, FH, hohem Lipoprotein a [Lp(a)] bzw. chronischer Niereninsuffizienz zur Gruppe mit hohem oder sehr hohem CV-GR (s. Tab. 2). Anders als in den US-amerikanischen Leitlinien aus dem Vorjahr (2) verschwindet die Grenze zwischen Primär- und Sekundärprävention bei der Risikoabschätzung. Das beeinflusst entsprechend die Therapiewahl (s.u.).
Zudem wird gefordert, bei allen asymptomatischen Personen mit niedrigem und moderatem CV-GR aktiv nach sog. „Risikomodifiern“ zu suchen. Explizit genannt werden ein Herz-CT (Kalzium-Scoring) und ein Ultraschall der Hals- und Leistenarterien (2a/B). Ein koronarer Kalzium-Score > 100 und der Nachweis von atherosklerotischen Plaques in den genannten Arterien sollen zu einer Erhöhung der Risikostufe führen – die Anbieter der Untersuchungen werden sich freuen. Als weitere Risikomodifier werden ein pathologischer Knöchel-Arm-Index (Ankle Brachial Index) < 0,9 oder > 1,4 (vgl. 13), eine erhöhte Pulswellengeschwindigkeit (> 10 m/sek), erhöhte Lp(a)-, Apolipoprotein B- (ApoB) und CRP-Werte genannt sowie eine Hypertriglyzeridämie. Die Auswirkungen dieser Befunde auf das CV-GR bleiben allerdings offen. Zudem werden viele weitere risikoerhöhende Faktoren aufgezählt, wie ein vermehrter Bauchumfang, körperliche Inaktivität, psychosozialer Stress, eine positive Familienanamnese für frühzeitige KHK (Männer < 55 Jahre, Frauen < 60 Jahre) und chronisch verlaufende Autoimmunkrankheiten. Risikomindernde Faktoren (vgl. 3), wie z.B. hohe HDL-C-Werte oder eine Familienanamnese mit Langlebigkeit, werden nicht oder nur beiläufig erwähnt. Insgesamt entsteht so der Eindruck, dass die Einschätzung des individuellen Risikos intensiviert wird, obwohl eine Überschätzung des Risikos bei Risikorechnern ein bekanntes Problem ist (vgl. 4).
Nach den neuen Empfehlungen sollte beispielsweise bei einem 55-jährigen leicht übergewichtigen Mann, Nichtraucher, mit einem Blutdruck von 150/90 mm Hg ein vollständiges Lipidprofil erstellt werden: Gesamt-Cholesterin, LDL-C, HDL-C und TG (jeweils 1/C), zudem einmalig Lp(a) und ApoB (bei hohen TG, DM, Adipositas und metabolischem Syndrom oder sehr niedrigem LDL-C: 2a/C). Zudem wäre ein koronares Kalzium-Scoring und ein Gefäß-Ultraschall durchzuführen (2a/B). Wenn in der A. carotis ein atherosklerotischer Plaque (Größe?) gefunden wird, dann rückt er von der Kategorie „moderates CV-GR“ in die Kategorie „hohes CV-GR“ auf (s. Tab. 2).
Therapieziele: Auch diese werden in der europäischen Leitlinie nochmals verschärft, sogar im Vergleich zu den bereits sehr strengen Vorgaben der 10 Monate alten US-Leitlinie (2). Zudem werden Indikation und Art der lipidsenkenden Behandlung einem rigiden Behandlungsschema unterworfen.
Bei den Blutfetten ist das LDL-C der zentrale Zielparameter (1/C). Beobachtungsstudien, Mendelsche Randomisierungsstudien, verschiedene Interventionsstudien und Metaanalysen beweisen, dass eine kausale Beziehung zwischen der Höhe des LDL-C und dem Auftreten von CV-Ereignissen besteht und dass die Senkung des LDL-C zu einer kontinuierlichen Reduktion von CV-Ereignissen „ohne unteres Limit oder einem J-Kurven-Effekt“ führt, also: „the lower the better“ (vgl. 11). Zudem hätten sich aus den Studien bislang keine Hinweise darauf ergeben, dass sehr niedrige LDL-C-Konzentrationen gefährlich sind.
Daher soll nun bei allen Personen mit sehr hohem CV-GR ein LDL-C-Zielwert < 55 mg/dl angestrebt werden (Primärprävention: 1/C, Sekundärprävention: 1/A; s. Tab. 2). Bei Patienten, die unter einer maximal tolerierten Statin-Dosis innerhalb von 2 Jahren erneut ein CV-Ereignis haben, soll das LDL-C sogar auf < 40 mg/dl gesenkt werden (2b/B). Da selbst bei gesunden Personen mit niedrigem CV-GR das LDL-C-Ziel verschärft wird (< 115 mg/dl; 2b/A) wird nun wahrscheinlich mehr als die Hälfte der erwachsenen Bevölkerung zum Behandlungsfall. Die Task Force räumt ein, dass die Beweislage für die neuen Zielwerte „limitiert“ ist und dass es keine RCT gibt, die prospektiv die LDL-C-Senkung in die genannten Zielbereiche untersucht hat. Die Vorgaben dienten daher als Grundlage für die gemeinsame Entscheidungsfindung mit den Patienten. Die finale Entscheidung habe individuell zu erfolgen, so die Aussage in der Präambel.
Behandlungsalgorithmus: Er sieht zunächst Maßnahmen mit Modifikation des Lebensstils vor. Für alle Personen gilt: Nichtrauchen; fettarme Ernährung mit Schwerpunkt auf Vollkornprodukten, Gemüse, Obst und Fisch; 3,5-7 Std. Bewegung pro Woche; ein BMI zwischen 20 und 25 sowie ein Taillenumfang von < 94 cm bei Männern und von < 80 cm bei Frauen. Da durch diesen Lebensstil allenfalls eine LDL-C-Senkung von 10-15% zu erwarten ist – eine Gewichtsreduktion von 10 kg senkt das LDL-C nur um 8 mg/dl – soll in der nächsten Stufe ein Statin eingenommen werden (1/A). Mit einer Statin-Hochdosistherapie ist eine LDL-C-Senkung von maximal 50% zu erwarten. Eine Kontrolle des LDL-C wird nach frühestens 6 Wochen empfohlen. Werden die Zielvorgaben mit der maximal tolerierten Statin-Dosis nicht erreicht, soll zusätzlich Ezetimib gegeben werden (1/B). Als Beleg für diese Empfehlung werden Ergebnisse der 5 Jahre alten und an dieser Stelle mehrfach kritisierten IMPROVE-IT-Studie genannt, die bei Hochrisiko-Patienten keinen Vorteil von Ezetimib hinsichtlich der Letalität ergab (vgl. 5).
Werden durch die maximal tolerierte Statin-Dosis plus Ezetimib die LDL-Vorgaben nicht erreicht, dann soll ein PCSK9-Hemmer injiziert werden (Sekundärprävention 1/A; Primärprävention 2b/C). Diese Wirkstoffe senken das LDL-C um ca. 60% und in Kombination mit Hochdosis-Statin und Ezetimib um etwa 85%. „Erste vorläufige Daten aus Phase-III-Studien legen nahe, dass die CV-Ereignisse im Einklang mit der erzielten LDL-C-Senkung reduziert werden“ – so die Begründung für diese Empfehlung. Bei den zitierten Studien handelt es sich um FOURIER bzw. ODYSSEY Outcomes. In beiden Studien wurde der primäre kombinierte Endpunkt um 15% reduziert, allerdings ohne signifikanten Effekt auf die CV-Letalität (vgl. 6, 7). Daten zur Langzeit-Sicherheit dieser Wirkstoffgruppe liegen nicht vor.
Wenn der oben geschilderte Mann ohne Vorbehandlung ein LDL-C von 180 mg/dl hat, müsste dieses bei hohem CV-GR um > 50% und auf < 70 mg/dl gesenkt werden (1/A). Dazu ist – wenn möglich – eine deutliche Veränderung des Lebensstils erforderlich und die Einnahme der maximal tolerierten Statin-Dosis. Damit käme er vermutlich auf ein LDL-C von 90-100 mg/dl. Mit zusätzlich 10 mg Ezetimib käme er vielleicht auf 80 mg/dl. Immerhin: ein PCSK9-Hemmer wird dann nicht zusätzlich empfohlen. Diese Arzneimittel sind für die sehr hohe CV-RG (1/A) und für die völlig Statin-intoleranten Patienten (2b/C) reserviert. Verträgt der Mann keine hohen Statin-Dosen, soll über zusätzlich einzunehmendes Cholestyramin nachgedacht werden (zu erwartende LDL-Senkung 20%, 2b/C).
Weitere bemerkenswerte Veränderungen in der neuen Lipid-Leitlinie sind:
-
Bei jeder Hypertriglyzeridämie > 200 mg/dl werden Statine zur Reduktion des CV-GR empfohlen (1/B). Personen mit sehr hohem CV-GR und TG-Werten zwischen 135-499 mg/dl trotz Statin-Behandlung sollen zusätzlich hochdosiert reine Eicosapentaensäure (PUFA; Fischölkapseln) erhalten (2a/B). Diese Empfehlung wird aus der REDUCE-IT-Studie abgeleitet, die wir wegen verschiedener möglicher Verzerrungen, u.a. Interaktionen des verwendeten mineralölhaltigen Plazebos mit den übrigen Medikamenten, sehr kritisch kommentiert haben (12).
-
Bei Personen > 75 Jahre und hohem CV-GR (dazu zählen alle mit einer eGFR < 60 ml/min) soll eine Primärprävention mit Statinen in Betracht gezogen werden (2b/B). Wenn die Nierenfunktion signifikant eingeschränkt ist oder Arzneimittelinteraktionen zu befürchten sind, soll das Statin mit niedriger Dosis begonnen und langsam auftitriert werden (1/C).
-
Alle Menschen mit eingeschränkter Nierenfunktion (eGFR < 60 ml/min) sollen lipidsenkend behandelt werden. Statine bzw. die Kombination mit Ezetimib wird für alle empfohlen, die nicht im Zielbereich sind und nicht dialysiert werden (1/A). Wenn die Patienten dialysepflichtig werden, soll mit Statin und/oder Ezetimib weiterbehandelt werden, obwohl es zu dieser Empfehlung keine Studien gibt (2a/C).
-
Bei Patienten nach ACS wird grundsätzlich eine Hochdosis-Statin-Behandlung empfohlen, unabhängig von den LDL-C-Werten. Ist trotz maximal tolerierter Statin-Dosis plus Ezetimib das LDL-C nicht < 55 mg/dl zu senken, wird eine Behandlung mit einem PCSK9-Hemmer früh nach dem Ereignis und möglichst schon während des stationären Aufenthalts empfohlen (1/B).
Kritik: Die Empfehlungen der Task Force erfüllen nicht die Kriterien einer S2- oder S3-Leitlinie. Das Gremium ist weder repräsentativ besetzt, noch wurden klinisch relevante Fragen (z.B. zu den LDL-Zielwerten) gestellt und durch eine systematische Recherche und Bewertung der Literatur beantwortet. Wahrscheinlich hat auch keine strukturierte Konsensfindung stattgefunden. Das kann aber nicht genau beurteilt werden, denn es liegt kein detaillierter Leitlinienreport vor – heute ein üblicher Qualitätsstandard jeder Leitlinie. Auch werden die inhaltlichen Abweichungen von der qualitativ höher einzuschätzenden US-Leitlinie nicht begründet. Dem Konzept „the lower the better“ wird alles untergeordnet; Wirkstoffe wie Ezetimib und PUFA erhalten Grad-1- oder 2a-Empfehlungen ohne stichhaltige Belege dafür, dass sie eine günstige Nutzen-Risiko-Relation haben. In einer oberflächlichen Kosten-Nutzen-Analyse zur Anwendung von PCSK9-Hemmern kommen die Autoren außerdem zu einer für eine Leitlinie ungewöhnlichen Voraussage, dass diese Medikamente nach breiterer Anwendung wahrscheinlich im Preis sinken werden.
Es handelt sich bei den Empfehlungen der ESC und EAS maximal um eine S1-Leitlinie, d.h. eine Handlungsempfehlung einer Expertengruppe in einem informellen Konsensverfahren. Der Wert dieser Empfehlungen wird auch dadurch in Frage gestellt, dass nur 2 der 21 Autor(inn)en keine Interessenkonflikte mit pharmazeutischen Unternehmern (pU) angeben – ein Autor gibt sogar Interessenkonflikte mit 48 pU an. Knapp 70% der Autor(inn)en haben Interessenkonflikte mit den Herstellern der PCSK9-Hemmer. Die Task Force handelt also nicht unabhängig. Auch von den 86 Reviewern aus 51 mit der ESC assoziierten nationalen kardiologischen Gesellschaften geben nur 16 keine Interessenkonflikte an (18%). Das verwundert nicht, denn die ESC selbst hat erhebliche Interessenkonflikte mit der Industrie. Laut dem Jahresbericht 2018 ist sie zwar eine “volunteer-led, not-for-profit medical society” (8), jedoch kommen 75,5% ihrer jährlichen Gesamteinnahmen von 71,9 Mio. € direkt oder indirekt von der Industrie. Daher stellt sich ernsthaft die Frage, ob derartige Fachgesellschaften überhaupt Leitlinien erstellen sollten (vgl. 9).
Literatur
- Mach, F., et al.: Eur. Heart J. 2019 Aug 31. Link zur Quelle
- Grundy, S.M., et al.: J. Am. Coll. Cardiol 2018, 73, e285. Link zur Quelle
- AMB 2019, 53, 57. Link zur Quelle
- AMB 2014, 48, 01. Link zur Quelle
- AMB 2015, 49, 04. Link zur Quelle
- AMB 2017, 51, 33. Link zur Quelle
- AMB 2018, 52, 91. Link zur Quelle
- https://www.escardio.org/static_file/… Link zur Quelle
- AMB 2019, 53, 08DB01. Link zur Quelle
- https://www.escardio.org/ static_file/Escardio/Subspecialty/ EACPR/Documents/risk-assessment-score-card.pdf Link zur Quelle
- AMB 2015, 49, 88DB01. Link zur Quelle
- AMB 2019, 53, 03. Link zur Quelle
- Diem, C., et al.: Link zur Quelle